노화는 평생 동안 발생하는 복잡한 생물학적 과정으로서 다양한 만성 질환의 발병의 핵심 요소이며, 특히 알츠하이머 병 (AD) 의 위험과 상당히 관련이 있습니다. 그러나 그 기본 메커니즘은 아직 밝혀지지 않았습니다.
신경 에너지 대사에서 ATP와 구조적으로 유사한 핵심 분자 인 구아노신 삼인산 (GTP) 은 세포 에너지 공급에 참여할뿐만 아니라 시냅스 가소성 유지, 소포 수송에도 중요한 역할을합니다. 및자가 포식 조절. 어바인 캘리포니아 대학 (University of California, Irvine) 의 한 팀이 GeroScience에 발표 한 최근 연구에 따르면 "GTP 수준의 연령 관련 감소 치료는 세포 내 구균과 자가 포식을 회복합니다." 노화 중에 뉴런에서 GTP 수치가 감소하면 세포 내 구증과자가 포식 기능이 손상된다는 것을 알 수 있습니다.
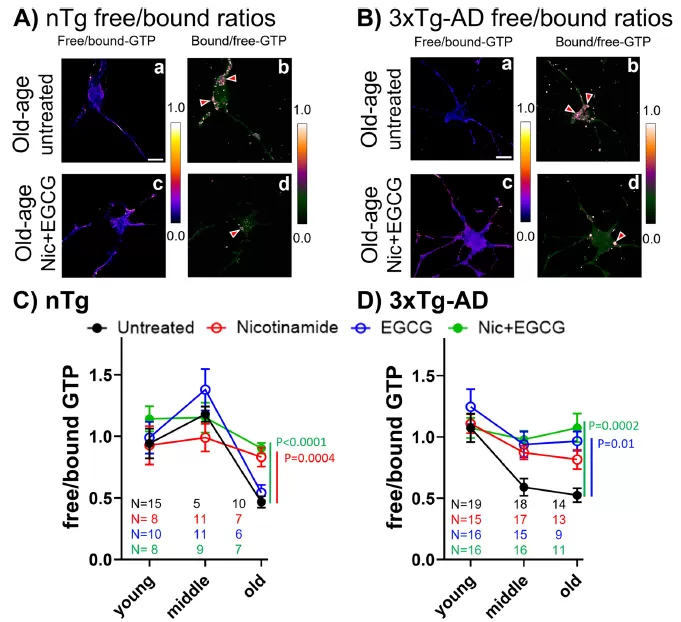
이 연구는 노화 된 마우스 모델을 사용하여 니코틴 아미드 (NAD 전구체, 비타민 B3 의 한 형태) 및 녹차 폴리 페놀 EGCG (Nrf2 활성화제) 와 함께 보충제를 결합한 것으로 나타났습니다. 노화 된 뉴런의 GTP 수준을 16-24 시간 내에 젊은 상태로 회복했습니다. 이 개입은 세포 내 구분 및자가 포식을 크게 향상시킬뿐만 아니라 22% 년까지 β-아밀로이드의 제거와 신경 생존율을 증가시켜 노화 관련 신경 퇴행성 질환에 개입하기위한 새로운 접근법을 제공했습니다.

캘리포니아 대학교 어바인 (Irvine) 의 연구팀은 뉴런 내 GTP 수준의 변화와 다른 연령대에 걸친 세포 기능에 미치는 영향을 체계적으로 분석했습니다 (젊은: 2-6 개월, 중년: 8-11 개월, 구: 17-28 개월) 알츠하이머 병 (AD) 모델 마우스 및 자연 노화 대조군 마우스 사용. 형광 센서를 사용하여 살아있는 세포의 GTP 수준을 실시간으로 모니터링함으로써 연구 결과는 다음과 같습니다.
노화는 뉴런 (특히 미토콘드리아) 에서 GTP 수준을 현저하게 감소시키는 반면, AD 모델 마우스는 조기에 더 심각한 GTP 감소를 나타냅니다. AD가 에너지 대사 기능 장애를 가속화 할 수 있음을 시사합니다.
Autophagy의 핵심 에너지 기질로서, GTP 수준은 직접 autophagic 활성에 영향을 미치며, autophagy의 활성화는 GTP 축적을 유도하는 반면, autophagy의 활성화는 GTP 소비를 가속화합니다.
나이가 들어감에 따라자가 포식 관련 GTPases (예: Rab7 및 Arl8b) 는 GTP 결핍으로 인한 소포 수송 장애와 관련 될 수있는 뉴런에 비정상적으로 축적됩니다.
니코틴 아미드 (NAD 전구체) 및 녹차 폴리 페놀 EGCG (Nrf2 활성화 제) 와의 복합 개입은 노화 된 뉴런의 GTP 수준을 16-24 시간 내에 젊음 수준으로 회복시킬 수 있습니다.
이 치료는 Rab7/Arl8b-positive 소포의 수와 크기를 크게 줄여 GTP 항상성을 회복하여자가 포식 리소좀 기능을 향상시키는 능력을 보여줍니다.
이 연구는 노화 및 AD에서 에너지 대사 기능 장애의 일반적인 메커니즘을 밝혀 줄뿐만 아니라 GTP 대사 표적 신경 보호 전략에 대한 실험적 증거를 제공합니다.
(니코틴 아미드 EGCG 치료는 신경 GTP 수준을 회복시킵니다)
또한, 병용 요법은 세포 내 β-아밀로이드 단백질의 제거, 단백질 산화 수준 감소 및 22% 의한 신경 생존율 증가를 촉진시켰다. 이러한 발견은 GTP 수준의 복원이 Aβ 및 산화적으로 손상된 단백질의 제거를 촉진한다는 것을 입증한다.
연구팀은이 연구가 노화 및 알츠하이머 병 (AD) 진행에서 GTP 대사의 중요한 조절 역할에 대한 최초의 체계적인 설명을 나타냅니다. 그러나 현재의 연구는 주로 체외 세포 실험을 기반으로하기 때문에 임상 번역은 여전히 동물 모델 및 인간 임상 시험을 통한 추가 검증을 필요로합니다.
특히, 최근의 임상캘리포니아 대학 (University of California) 이 실시한 실험에서 경구 투여 된 니코틴 아미드는 혈류에서 생체 불활성화되기 쉽고 치료 효능을 제한하는 것으로 나타났습니다. 이 발견은 향후 연구가 약물 전달 방법을 최적화하거나 치료 효율을 개선하기 위해보다 안정적인 약물 전달 시스템을 개발해야 함을 시사합니다.
이러한 도전에도 불구하고이 연구는 상당한 이론적 가치를 가지고 있습니다. 그것은 신경 퇴행성 질환에서 GTP 항상성의 중심 역할을 드러낼뿐만 아니라 새로운 개입 전략을 개발하기위한 과학적 토대를 마련합니다. 이러한 발견은 궁극적으로 노화 및 AD의 병리학 적 과정을 지연, 중단 또는 역전시키는 잠재적 인 치료 표적을 제공합니다.
참조:
https://doi.org/10.1007/s11357-025-01786-4